胆囊癌(Gallbladder cancer, GBC)是人类胆道系统最常见的恶性肿瘤,其侵袭性强,预后极差,中位OS小于1年。由于缺乏典型的临床症状,70%~80%患者确诊时已为晚期,5年生存率低于5%。目前,手术切除是治愈胆囊癌的唯一机会,可对I-IVa期患者实施根治性切除手术,但实际治愈的可能性很低,仅有不到15%的患者有机会行根治性切除术,术后复发率高达70%~80%。随着近年来包括TOPAZ-1和KEYNOTE-966等结合免疫治疗的临床研究结果的公布,以PD-1/PD-L1免疫检查点抑制剂为代表的免疫联合化疗/靶向的疗法正逐渐改变着胆囊癌治疗的格局。然而,仍有大量患者无法从现有的免疫治疗中获益,因而如何进一步明确免疫获益人群的机制,扩大治疗受益人群是一项持续的挑战。肿瘤的免疫反应是肿瘤发生发展过程中的重要过程,脱离机体免疫监控后肿瘤的恶性生物学行为将会进一步加快,从而促进肿瘤的增殖、侵袭和转移,因此探究肿瘤的免疫逃逸(immune escape)机制对于改善免疫治疗效果具有重要作用。

龚伟教授团队通过多组学联合分析,发现胆囊癌中可变剪切因子多嘧啶区结合蛋白3(PTBP3)呈高表达并促进IL-18的外显子跳跃,并产生肿瘤相关特异表达的ΔIL-18,失去其原有的激活CTL及抑制肿瘤功能。进一步的功能实验揭示Δ IL-18能促进胆囊癌免疫逃逸。相关研究成果近日以PTBP3 Mediates IL-18 Exon Skipping to Promote Immune Escape in Gallbladder Cancer为题,发表在Advanced Science上。
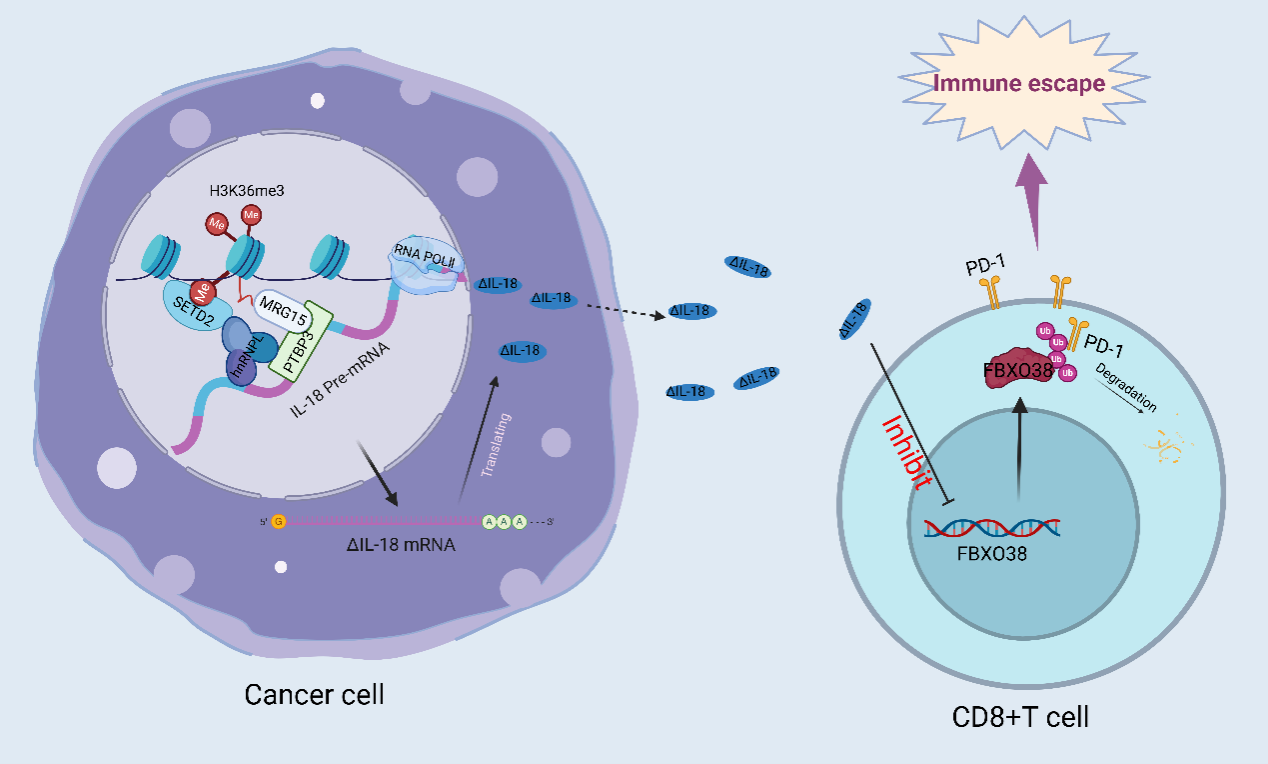
可变剪切是一种重要的转录后调控机制,其异常与人类多种肿瘤的发生有关。课题组赵成博士(第一作者)结合GEO数据库和胆囊癌标本的mRNA-seq分析后发现可变剪切因子PTBP3在胆囊癌中高表达,进一步联合多组学分析表明,高表达的PTBP3促进了胆囊癌细胞IL-18发生外显子6跳跃,产生了肿瘤所特异表达的ΔIL-18。体内外的功能实验显示ΔIL-18能通过下调CD8+T细胞中的FBXO38转录水平以减少PD-1泛素化降解,从而促进胆囊癌的免疫逃逸。课题组研究人员也开发了一系列针对IL-18外显子跳跃的寡核苷酸药物ASOs,以此阻断肿瘤细胞中ΔIL-18的产生;发现其中ASO4能够加强抗PD-1药物的疗效,且小鼠体内实验表明其具有良好的生物安全性。pre-mRNA发生的可变剪切过程经常与基因转录过程同时进行,而可变剪切位点的选择受到RNA聚合酶II延长率、染色质重塑剂和组蛋白去乙酰化酶抑制剂的影响。研究人员发现在剪切过程中,组蛋白修饰H3K36me3通过MRG15招募PTBP3,耦合IL-18的剪切和转录过程,从而促进IL-18的外显子6跳跃。在此过程中,H3K36甲基转移酶SETD2通过SHI结构域与hnRNPL结合,从而干扰了PTBP3与IL-18 pre-mRNA的结合。
这项研究创新性地发现PTBP3能促进细胞因子IL-18的外显子跳跃,并进一步促进胆囊癌免疫逃逸。这项研究的完成有助于阐明胆囊癌发生过程中可变剪切异常导致免疫逃逸的机制,并有助于通过阻断可变剪切产生的ΔIL-18对PD-1的异常,为临床工作提高胆囊癌免疫治疗的疗效提供了新的视角和作用靶点。
附属新华医院普通外科龚伟教授、吴向嵩教授和董平教授为共同通讯作者。该论文第一作者为附属新华医院赵成博士、赵经委博士、张钰涵助理研究员和朱逸荻主治医师。

